¿Cómo distinguir entre moléculas polar y no polar?

Para entender cómo distinguir entre moléculas polar y no polar, es importante comprender la diferencia entre ellas. Las moléculas polar tienen una distribución desigual de cargas eléctricas, lo que significa que tienen un polo positivo y un polo negativo. Por otro lado, las moléculas no polar tienen una distribución simétrica de cargas eléctricas y no tienen polos positivos o negativos.
Una forma de determinar si una molécula es polar o no polar es examinando las diferencias en electronegatividad entre los átomos que la componen. La electronegatividad es la capacidad que tiene un átomo para atraer electrones hacia sí mismo en un enlace químico. Si los átomos en una molécula tienen una diferencia significativa en electronegatividad, es probable que la molécula sea polar.
Una herramienta útil para distinguir entre moléculas polar y no polar es la regla del centro de simetría. Si una molécula tiene un centro de simetría, es probable que sea no polar. Esto se debe a que una molécula con un centro de simetría tiene una distribución de carga eléctrica equilibrada en todas las direcciones, lo que resulta en una netamente nula. Por otro lado, si una molécula no tiene un centro de simetría, es probable que sea polar.
Otra forma de identificar una molécula polar es considerar su geometría molecular. Por ejemplo, una molécula lineal con átomos de diferentes electronegatividades será polar. Esto se debe a que los dipolos individuales de los enlaces polares no cancelarán entre sí y se producirá una molécula polar en su conjunto.
En resumen, distinguir entre moléculas polar y no polar requiere examinar la diferencia de electronegatividad entre los átomos, el centro de simetría de la molécula y su geometría molecular. Estos distintos factores permiten determinar si una molécula es polar o no polar, lo cual es fundamental para comprender sus propiedades químicas y su interacción con otras sustancias.
¿Qué significa que algo sea polar o no polar?
Polaridad es un concepto que se utiliza en diversos campos, como la química y la física, para describir la naturaleza de una sustancia o de un enlace. En términos generales, cuando hablamos de algo que es polar nos referimos a que existe una asimetría en la distribución de carga eléctrica en la molécula o en el enlace, mientras que cuando algo es no polar, la distribución de carga es simétrica.
Un elemento clave para determinar la polaridad de una sustancia es su estructura molecular. En una molécula polar, los átomos que la forman no comparten la carga por igual, lo que resulta en una distribución asimétrica de electrones. Esto ocurre cuando hay una diferencia de electronegatividad entre los átomos que forman la molécula. La electronegatividad es la capacidad de un átomo para atraer electrones hacia sí mismo en un enlace químico. Por lo tanto, si hay una diferencia significativa de electronegatividad entre los átomos, es probable que la molécula sea polar.
Por otro lado, en una molécula no polar, los electrones se distribuyen de manera uniforme entre los átomos que la componen, lo que resulta en una distribución simétrica de la carga eléctrica. Esto ocurre cuando los átomos que forman la molécula tienen una electronegatividad similar o cuando los átomos están distribuidos de manera simétrica en el espacio.
La polaridad también puede aplicarse a los enlaces entre átomos. Un enlace es polar cuando uno de los átomos tiene mayor electronegatividad que el otro, resultando en una distribución desigual de carga eléctrica a lo largo del enlace. Un enlace no polar, en cambio, se da cuando los átomos comparten los electrones de manera equitativa.
Es importante destacar que la polaridad de una sustancia puede tener implicaciones importantes en sus propiedades físicas y químicas. Por ejemplo, las sustancias polares tienden a ser solubles en disolventes polares y a interactuar con otras sustancias polares. Además, la polaridad puede influir en la capacidad de una molécula para formar enlaces o interacciones intermoleculares.
En resumen, la polaridad se refiere a la distribución de carga eléctrica en una sustancia o en un enlace. Si algo es polar, las cargas eléctricas están distribuidas de manera asimétrica, mientras que si es no polar, la distribución de carga es simétrica. La polaridad está determinada por la diferencia de electronegatividad entre los átomos que forman una molécula o un enlace, así como por la estructura espacial de la molécula.
¿Cuál es la diferencia entre polar y no polar?
La diferencia entre polar y no polar radica en la distribución de cargas eléctricas dentro de una molécula.
En una molécula polar, los electrones son compartidos de manera desigual entre los átomos que forman la molécula. Esto ocurre cuando hay una diferencia de electronegatividad entre los átomos. La electronegatividad es la capacidad de un átomo para atraer electrones hacia sí mismo. Cuando un átomo es más electronegativo que otro, atraerá con mayor fuerza los electrones, creando una región negativa en la molécula. Por otro lado, el átomo menos electronegativo tendrá una región positiva. Esta separación de cargas genera un dipolo, lo que hace que la molécula sea polar.
En contraste, en una molécula no polar no hay una separación clara de cargas. Esto ocurre cuando los átomos que forman la molécula tienen una diferencia de electronegatividad muy pequeña o nula. En este caso, los electrones se comparten de manera igualitaria entre los átomos, lo que resulta en una distribución simétrica de cargas. Estas moléculas no tienen un dipolo permanente y no son atraídas por un campo eléctrico. Algunos ejemplos de sustancias no polares son el oxígeno molecular (O2) y el nitrógeno molecular (N2).
La solubilidad de una sustancia en agua también está relacionada con su polaridad. Las sustancias polares tienden a ser solubles en agua, ya que pueden interactuar con las moléculas de agua mediante enlaces de hidrógeno. Por otro lado, las sustancias no polares son insolubles en agua y tienden a separarse formando una capa sobre la superficie del agua.
En resumen, la diferencia entre polar y no polar radica en la distribución de cargas dentro de una molécula. Las moléculas polares presentan una separación de cargas, mientras que las moléculas no polares no tienen esta separación. Esto tiene implicaciones en las propiedades físicas y químicas de las sustancias, como su solubilidad.
¿Qué significa que sea polar?
La palabra "polar" puede tener diferentes significados dependiendo del contexto en el que se utilice. Sin embargo, cuando se habla de algo o alguien que es "polar", generalmente se hace referencia a una característica que indica opuestos extremos o polos opuestos.
En física, por ejemplo, se utiliza el término "polar" para describir una molécula que tiene una distribución desigual de cargas eléctricas, lo que resulta en una molécula con un polo positivo y uno negativo. Esto se debe a que los electrones que rodean los átomos de la molécula se encuentran más cerca de uno de los extremos, creando una asimetría en la distribución de las cargas.
En el ámbito geográfico, el término "polar" está asociado a las regiones cercanas a los polos de la Tierra. Esto se debe a que estas zonas se caracterizan por tener temperaturas extremadamente frías, con una cobertura permanente de hielo y nieve. Además, en estas regiones se pueden encontrar animales adaptados a estas condiciones extremas, como los osos polares.
En el ámbito social y político, por otro lado, el término "polar" se utiliza para describir una situación en la que hay una división o separación entre dos grupos o posiciones extremas. Esto puede ocurrir en diferentes contextos, como en discusiones políticas o debates sobre temas controvertidos. La polarización puede dar lugar a tensiones y confrontaciones, ya que las personas se alinean y defienden posturas diametralmente opuestas.
En resumen, el término "polar" se refiere a la existencia de polos opuestos o extremos en diferentes ámbitos de la vida, ya sea en el campo científico, geográfico o social. Estas polaridades pueden manifestarse en forma de asimetrías en la distribución de cargas eléctricas en una molécula, en las características climáticas de las regiones polares o en la división y confrontación de opiniones en el ámbito social y político.
¿Qué es no polar ejemplo?
El término "no polar" se refiere a una molécula o enlace que no tiene una carga eléctrica desigualmente distribuida. Esto significa que la molécula tiene una distribución uniforme de electrones alrededor de los átomos que la componen, lo que resulta en una falta de cargas eléctricas positivas o negativas concentradas en un área específica.
Un ejemplo común de una molécula no polar es el oxígeno diatómico (O2). En esta molécula, los dos átomos de oxígeno están unidos por un enlace covalente, lo que implica que comparten electrones de manera igual. Como resultado, no hay una carga desigualmente distribuida en la molécula, lo que la convierte en un ejemplo de molécula no polar.
Otro ejemplo de una molécula no polar es el nitrógeno diatómico (N2).
En contraste, una molécula polar es aquella en la que hay una distribución desigual de electrones, lo que genera una separación de cargas eléctricas. Un ejemplo de esto es la molécula de agua (H2O), donde el oxígeno atrae más fuertemente a los electrones que los átomos de hidrógeno, lo que resulta en una distribución desigual de carga en la molécula.
En resumen, una molécula no polar es aquella en la que no hay una separación desigual de cargas eléctricas y sus electrones se distribuyen de manera uniforme entre los átomos que la componen. Esto puede ser determinado por la simetría de la molécula y la electronegatividad de los átomos involucrados en los enlaces covalentes.
Libros de química

La química de lo bello: Un relato científico sobre el arte y las bellezas cotidianas (Contextos)


Lecciones de química (Salamandra Narrativa)


Mi vida es química: Móviles, café, emociones... Cómo puedes explicar todo con química (Ariel)


Reacciones sin fin: No es magia, es química (Para curiosos)

Kits de modelos moleculares

Modelo Molecular Kit de Estructura Orgánica Inorgánica Química 240 Unids con Átomo Enlaces y Guía de Instrucción para Maestros Estudiantes y Científicos Poweka
- ►【EL PAQUETE INCLUYE】: Este total de 240 piezas de Molecular Model Kit contiene 86 átomos (en 12 elementos diferentes, carbono, hidrógeno, oxígeno, nitrógeno, metal, fósforo, yodo, flúor, cloro, bromo, azufre y boro), 153 enlaces y un eliminador de enlaces, que hace que sea muy fácil construir modelos para modelos de química orgánica e inorgánica e incluye enlaces largos y flexibles que son perfectos para hacer enlaces dobles y triples, así como enlaces de enlace simple de longitud media y corta
- ►【APTO PARA】: Todas las edades mayores de 3 años (piezas pequeñas. No para niños menores de 3 años), modelando estructuras químicas simples y pequeñas a más avanzadas y complejas para escuelas y universidades, estudiantes de todas las edades, maestros, investigadores y entusiastas
- ►【FÁCIL DE IDENTIFICAR Y USAR】: Código de colores a los estándares universales. Los átomos están codificados por colores para que sean estándar, lo que lo hace más fácil para usted. Diseño de caja inteligente con compartimentos de almacenamiento fáciles para un almacenamiento conveniente
- ►【FÁCIL DE ENSAMBLAR Y DESMONTAR】: Puede ensamblar estructuras complejas en minutos. El kit de modelo molecular para química orgánica contiene un diseño de alta calidad de átomos y enlaces que se conectan y desconectan sin problemas para garantizar que no se canse los dedos. Extractor de enlaces adicional incluido para hacer que la tarea de desarmar las estructuras de su kit de modelo molecular sea súper fácil y rápida. Esto es muy útil para que los estudiantes estudien geometría molecular
- ►【UN GRAN REGALO】: Este kit de modelo molecular de química orgánica viene con una guía de instrucciones para identificar fácilmente todos los átomos y conectores, además de un kit de inicio de química de cuatro páginas. Es un modelo completo para la química, un gran regalo para cumpleaños, día del niño, día de agradecimiento y navidad

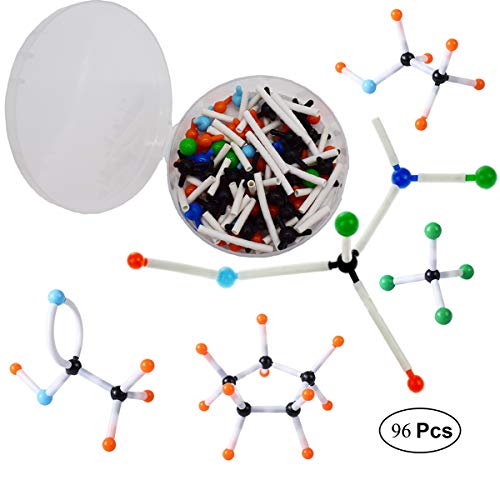
Mengger Modelos Moleculares Kit 96pcs Química Orgánica e Inorgánica Química Científica atomía Atomizador enseñanza Set de Aprendizaje Molecular Modelo Molecular
- 【El paquete contiene】 Hay 54 modelos de átomos de 5 elementos químicos diferentes, 42 enlaces de 2 longitudes diferentes y un removedor de enlace incluido en el paquete. Fácil de usar
- 【Material no tóxico】 de plástico duradero de alta calidad. Viene con una carcasa de plástico resistente para el almacenamiento.
- 【Fácil de usar】 Fácil de conectar y desconectar, ligero y portátil. Caja duradera para un fácil almacenamiento!
- 【Perfect Advantage 】Permite a los usuarios construir moléculas orgánicas e inorgánicas virtualmente simples y complejas; Modelos educativos perfectos para la enseñanza de química orgánica e inorgánica en la enseñanza y el aprendizaje avanzado de ciencias en laboratorios.
- 【Multipropósito】 Son un kit de modelado molecular de aprendizaje interactivo y divertido para estudiantes, maestros, investigadores y entusiastas para usar en salones de clase o hogares. Además, pueden tomarse como el regalo de aprendizaje de la ciencia.

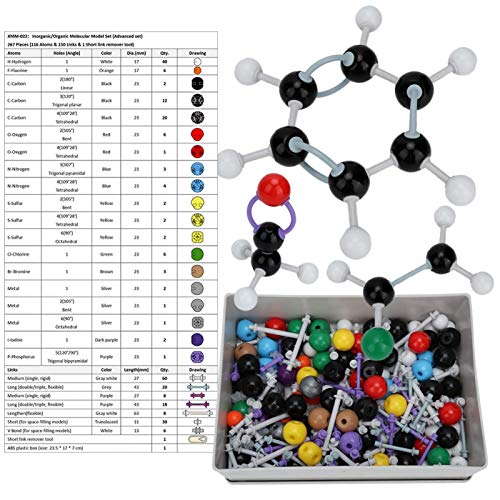
Delaman Atom Model, 267 Pcs Kit de Estructura aMolecular Orgánica Atom Link Model Set Herramientas Educativas para Estudiantes Maestros
- 【Materials Materiales de alta calidad】 Este modelo de átomo está hecho de plástico ecológico, es muy seguro y no se romperá, y tiene una larga vida útil.
- 【Motivar el interés】 Este modelo atómico puede aumentar el interés de los estudiantes en el aprendizaje, y el profesor puede explicarlo de manera más intuitiva. Muy conveniente.
- 【Multipropósito】 Este modelo atómico se puede usar como un tutorial de química inorgánica/orgánica, modelo de estructura molecular orgánica y modelo de estructura molecular esférica.
- 【Ampliamente utilizado】 Este modelo de átomo se puede utilizar para construir una variedad de modelos de estructura molecular orgánica orgánica C, H, O, N, Br, l comunes y ligeramente complejos, adecuados para la enseñanza y el uso en laboratorio.
- 【Lista de paquetes】 Nuestro paquete tiene 116 * Modelo Atom; 150 * Enlace; 1 * Herramienta de enlace; 1 * Caja de plástico.


Kare & Kind Kit de Química Orgánica de 240 Piezas Profesores y Estudiantes – 86 Átomos, 153 Enlaces, 1 Herramienta Removedora de Enlaces, Manual de Instrucciones, Caja Plástica de ABS
- CONJUNTO DE CONSTRUCCIÓN CONFIABLE >> Usar un kit modelo molecular es beneficioso para entender tanto las propiedades moleculares físicas como las químicas. Este kit incluye 240 piezas (86 átomos, 153 enlaces y 1 herramienta removedora de enlaces). El conjunto puede ser usado para aprendizaje de química orgánica, inorgánica y funcional. Viene con una caja plástica de ABS pequeña de alta calidad que ofrece un fácil almacenamiento y facilidad al ubicar las piezas necesarias. Conjunto muy recomenda
- MODELO 3D PRECISO >> Los átomos codificados por colores se rigen por los estándares universales que garantizan precisión en la construcción de una estructura molecular. Es genial ver un modelo tridimensional (3D) opuesto a ver una 2D en los libros. Esto le permite formar estructuras simples y más complejas.
- DIVERTIDO APRENDIZAJE SOBRE QUÍMICA >> Aprender química puede ser complicado. El kit le permitirá ver las moléculas y los átomos de una forma más sofisticada. Esto elimina el problema de visualizar estructuras y ayuda a entender mejor los principios moleculares.
- FÁCIL Y EDUCATIVO >> Las piezas calzan perfectamente y son fáciles de remover. Son ligeras, resistentes y se pueden armar fácilmente. Esto le permite comparar múltiples moléculas sin tener que preocuparse sobre la estabilidad.desarma
- VARIOS USOS >> Por propósitos académicos, es bueno ilustrar compuestos orgánicos útiles. Utilícelo para formar estructuras moleculares por diversión o para ayudar en proyectos escolares o la tarea. Es una gran ayuda de estudio para todas las edades, profesores e inclusive instructores universitarios de química.

Productos de laboratorio como tubos de ensayo o matraces

Mobestech 2 Uds Matraz Erlenmeyer Botella De Agua Matraz Vasos De Plástico Botellas De Agua Laboratorio De Vidrio Matraces Erlenmeyer Vaso De Vidrio Matraz Cónico Vidrio Matraz De Vidrio
- Matraz de experimento de plástico: fabricado con material de vidrio de primera calidad, con excelente durabilidad y practicidad.
- Matraz erlenmeyer: ampliamente utilizado para aplicaciones de educación, química, investigación o ciencias de la vida, etc.
- Matraz de vidrio: engrosado y resistente, de a resistencia en ambientes corrosivos.
- Matraz de química: viene con matraces de fondo , convenientes para observar y distinguir.
- Matraz cónico de plástico: hecho de material de y respetuoso con el medio ambiente, y práctico para un uso prolongado.


15 Piezas Tubos de ensayo plastico,Tubo de ensayo,Probetas plastico,Tubos de ensayo transparente Tubo Ensayo con Tapones de Corcho,para Especias,Confitería,Laboratorio,12 * 75mm
- 💎Material de alta calidad: el tubo de ensayo está hecho de plástico duro engrosado, mano de obra fina, seguro e inodoro, de alta transparencia, duradero, no es fácil de corroer, no es fácil de romper.
- 💎Contenido del paquete: Recibirá 15 tubos de ensayo transparentes con 15 corchos naturales. La longitud del tubo de ensayo es de aproximadamente 75 mm y el diámetro es de aproximadamente 12 mm. Es pequeño, portátil y fácil de usar.
- 💎Alta transparencia: el tubo de ensayo es blanco altamente transparente y puede ver claramente el contenido en el tubo de ensayo.
- 💎Fácil de usar: los corchos son cónicos y trapezoidales, de fácil acceso y pueden ayudar a que los tubos de ensayo se sellen bien, y puede lavarlos y reutilizarlos.
- 💎Amplia gama de aplicaciones: estos pequeños y lindos tubos de ensayo se pueden usar para guardar muchos de sus artículos pequeños diarios, como: semillas de flores, dulces, especias, sales de baño, etc. También puede usarlos en el laboratorio para contener líquidos o polvos experimentales, etc.


Learning Resources Set de iniciación a Las Ciencias con Tubos de ensayo, Tubos de ensayo con Base Plana, Base para Colocar los Tubos, Material de Ciencias, Tubos de ensayo con Tapa (6 Tubos)
- TUBOS DE ENSAYO FABRICADOS PARA NIÑOS: Tubos de ensayo robustos con diseño hexagonal y base plana. No se deslizan rodando y se mantienen en pie por sí solos o sobre la base que incluye el set
- APRENDE EL MÉTODO CIENTÍFICO: Los niños pueden empezar a dominar el método científico haciendo los sencillos experimentos de las tarjetas
- LABORATORIO CASERO: Este set de instrumentos científicos incluye 6 tubos de ensayo para hacer experimentos científicos básicos en casa o en el aula. Las tapas de colores encajan en la boca de los tubos para evitar derrames durante los experimentos. Son fáciles de limpiar y guardar
- EXPERIMENTOS CIENTÍFICOS DIDÁCTICOS: Además de los tubos hexagonales con base plana, el set también incluye una guía de actividades con 4 experimentos científicos aptos para niños
- INCLUYE: 6 tubos de ensayo con base plana, 6 tapas de distintos colores, 1 cepillo reutilizable para limpiar los tubos, 1 base para colocar los tubos, 1 guía de actividades


Vesaneae 16 Piezas Tapones de Goma Sólida, Tapón de Goma Laboratorio, Tapones Goma Cónicos, Tapones de Sello de Lab, Tapones Goma Blanco para Probeta Matraces Botella de Tubo, 9 Tamaños
- ★Paquete: Incluye 16 tapones de goma sólida con 9 tamaños diferentes, 000#(2 piezas), 00#(2 piezas), 0#(2 piezas), 1#(2 piezas), 2#(2 piezas), 3#(2 piezas), 4 # (2 piezas), 6 # (1 pieza), 7 # (1 pieza). El tamaño específico puede referirse a la imagen.
- ★Material: Hecho de caucho sólido, con buena elasticidad y flexibilidad, resistente a altas temperaturas, resistente a ácidos y álcalis, no se disuelve ni se hincha en líquidos ácidos, reutilizable y duradero.
- ★ Buen sellado: diseño de forma cónica, puede tapar el orificio en el tubo de ensayo lo suficiente como para evitar que el líquido se escape o evitar que el líquido se contamine con aire y polvo, seguro y práctico.
- ★Fácil de usar: con una superficie lisa y una dureza moderada, fácil de enchufar y tirar, y un rendimiento resistente hace que no sea necesario preocuparse por romperlos como los tapones de vidrio.
- ★Aplicación: Los tapones de goma se pueden usar en tubos de ensayo, matraces y otros instrumentos experimentales. Adecuado para aplicaciones de laboratorio, escuela, hogar e industria.

